ChongMingS.COM崇明網訊 今天上午,全球頂級醫學期刊《新英格蘭醫學雜志》在線發表了口服核苷類抗新型冠狀病毒藥物VV116對比奈瑪特韋片/利托那韋片組合藥物(PAXLOVID)用于伴有進展為重度(包括死亡高風險因素)的輕至中度新冠病毒感染患者早期治療的Ⅲ期臨床研究成果。

VV116是我國科學家自主研發的一款抗新冠病毒口服藥,目前處于國際多中心Ⅲ期臨床研究階段。
這項研究由上海交通大學醫學院附屬瑞金醫院牽頭開展,是奧密克戎變異株流行期間,首個針對中國新冠感染者開展的小分子口服抗病毒藥物“頭對頭”Ⅲ期臨床研究。

《新英格蘭醫學雜志》論文截圖
結果顯示,研究主要終點達到設計的非劣效終點,相比PAXLOVID,VV116組的臨床恢復時間更短,安全性方面的顧慮更少。
我國自主研發新藥得到國際認可
中國工程院院士、瑞金醫院院長寧光表示:“這項發表在《新英格蘭醫學雜志》上的論文研究結果證實VV116的臨床療效不亞于PAXLOVID。如今中國疫情政策轉向,國門即將打開,我們這項研究不僅為全球抗新冠小分子藥物的研發和臨床應用提供了寶貴的數據和經驗,也將為中國抗疫事業做出貢獻。”
據介紹,VV116是一種RdRp(核糖核酸聚合酶)抑制劑,可抑制新冠病毒在人體內的復制。它由中國科學院上海藥物研究所、中國科學院武漢病毒研究所、中國科學院新疆理化技術研究所、中國科學院中亞藥物研發中心/中烏醫藥科技城(科技部“一帶一路”聯合實驗室)、臨港實驗室、旺山旺水和君實生物共同研發。君實生物與旺山旺水共同承擔該藥物在全球層面的臨床開發和產業化工作。
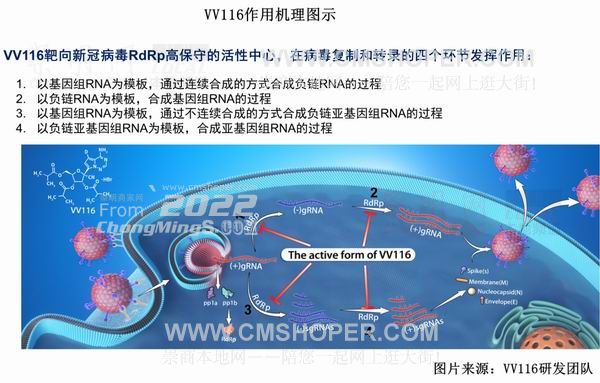
君實生物全球研發總裁鄒建軍博士說:“這項研究在《新英格蘭醫學雜志》的發表,證明了國際學術界對中國專家、中國制藥企業共同主導的藥物開發給予了高度認可。我們正在持續投入VV116在其他人群中的適應癥的臨床開發工作,希望能夠通過這款新療法為我國乃至全球新冠患者提供效果更好、更安全的治療選擇。”
臨床前研究顯示,VV116對新冠病毒原始株和已知突變株都表現出顯著的抗病毒作用,并在Ⅰ期臨床研究中表現出令人滿意的安全性、耐受性和藥代動力學性質。一項初步的小規模研究證實,與常規治療相比,首次核酸檢測為陽性后5天內接受VV116治療,患者的核酸轉陰時間更短。
與PAXLOVID進行多項指標對照
今天在《新英格蘭醫學雜志》上發表的是一項多中心、單盲(研究者保持盲態)、隨機、對照Ⅲ期臨床試驗,于今年4月4日至5月2日,在上海的7家新冠肺炎定點醫院聯合開展,共納入822例確診為伴有進展高風險的輕度至中度成人患者,按照1:1的比例被分配至VV116組和PAXLOVID組。最終,共有771例患者接受了VV116或PAXLOVID的治療。
這些患者的中位年齡為53歲(范圍:18—94歲),女性占比50.2%,輕癥患者占比92.1%,75.7%的患者全程接種新冠疫苗或接種過加強針,77.3%的患者在癥狀出現5天內接受了VV116或PAXLOVID治療?;颊咧凶畛R姷母唢L險因素包括:年齡≥60歲(37.7%)、心血管疾?。òǜ哐獕海?5.1%)、肥胖或超重BMI≥25(32.9%)、目前吸煙(12.5%)和糖尿病(10.1%)。
研究的主要終點是從隨機至持續臨床恢復的時間,風險比兩側95%置信區間下限>0.8定義為非劣效性。次要療效終點包括截至第28天進展為重度/危重或全因死亡的患者比例,新冠病毒感染相關癥狀評分和WHO臨床進展量表評分變化、至持續癥狀消失的時間、核酸陰性時間等。安全性終點包括不良事件和嚴重不良事件情況。
根據最終分析結果(截至今年8月18日),在受試患者中,VV116與PAXLOVID在“至持續臨床恢復的時間”達到非劣效,且VV116組比PAXLOVID組的中位恢復時間更短。
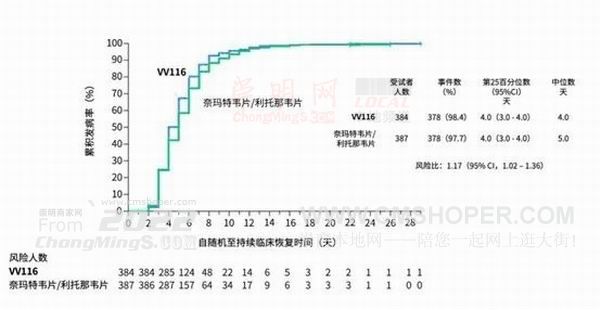
受試人群的至持續臨床恢復時間最終分析結果
VV116組和PAXLOVID組在“至持續癥狀消失的時間”“至首次核酸陰性時間”方面表現類似,中位時間均為7天。在每一個預設時間點(第5、7、10、14、28天),VV116組癥狀緩解的患者比例均高于PAXLOVID組。兩組患者均未發生進展為重度/危重或死亡。
在安全性方面,VV116比PAXLOVID的安全性顧慮更少。VV116組的不良事件發生率低于PAXLOVID組。值得注意的是,PAXLOVID與多種藥物存在相互作用,而VV116不會抑制或誘導主要藥物代謝酶,也不會抑制主要藥物轉運蛋白,所以與合并用藥發生相互作用的可能性很小。





















網友回復